gli ATOMI: struttura interna e massa
VIDEOLEZIONe PER RIPASSARE
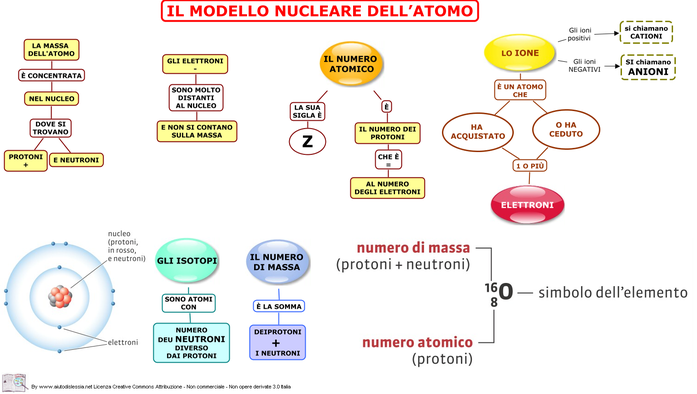
mappe (fonte: internet)

DOMANDE APERTE ED ESERCIZI (PER AUTOVERIFICA)
Domande aperte:
1.
2. 1. La struttura interna dell’atomo
2. le particelle subatomiche: massa in grammi e in u.m.a., carica, disposizione nell’atomo
3. il modello atomico di Rutherford: esperimento e conclusioni. Dimensioni dell’atomo e del nucleo
4. Z e A cosa rappresentano e come indicano la natura dell’atomo che abbiamo di fronte; come si ricavano n e numero di elettroni
5. cosa sono gli isotopi? Che differenza c’è dal punto di vista chimico e fisico tra isotopi dello stesso elemento?
6. Come si calcola la massa atomica di un elemento naturale, date le % degli isotopi?
7. Definizione di massa atomica (MA) e massa molecolare
8. Cosa rappresenta l’unità di massa atomica (u)e quanto vale in grammi
esercizi
1. Il nucleo di un atomo è formato da 49 protoni e 66 neutroni. Qual è il numero di elettroni dell’atomo neutro?
2. Qual è il numero di protoni, di neutroni e di elettroni di 80Br?
3. L’isotopo con Z = 38 e A = 88 appartiene a:…………….
4. L'isotopo con 19 elettroni,……….. protoni e 21 neutroni è l'elemento……
5. Conoscendo l’unità di massa atomica e la massa atomica, qual è la massa in grammi di un singolo atomo di argento?
6. Determina la massa molecolare di Na3PO4 (attenzione: è in g o in u?)
7. determina quanti atomi di oro sono contenuti in 1g di oro (Au)
8. Il boro naturale è costituito da due isotopi 10B e 11B . Il 19,91% è boro-10 con massa di 10,0129 u e l'80,09% è boro-11 con massa di 11,0093 u. Qual è la massa atomica relativa dell'elemento? Scrivi tutti i passaggi con cui arrivi al risultato
la mole
Esercizi sulla mole parte 1
9. 1 mol di K2MnO4 contiene
q 1 mol di atomi K, 1 mol di atomi Mn e 4 mol di atomi di ossigeno
q 2 mol di atomi K, 2 mol di atomi Mn e 4 mol di atomi di ossigeno
q 2 mol di atomi K, 1 mol di atomi Mn e 4 mol di atomi di ossigeno
q 1 mol di atomi K, 1 mol di atomi Mn e 1 mol di atomi di ossigeno
q 3 mol di acido carbonico H2CO3 corrispondono a 186 g. V F
10. La massa di 1 mol di elettroni è:
qinferiore alla massa di un atomo
quguale alla massa di un protone
qcirca 0,0005 g
qmaggiore della massa di 1 mol di neutroni
11. Qual è la massa di 1/3 di mole di titanio?
q47,87 g
q23,94 g
q15,96 g
q31,85 g
12. Quale campione ha la massa maggiore?
q2,0 mol di Zn
q2,0 mol di C
13.Quale dei seguenti campioni ha la maggiore massa?
q 1 mol di C2H6O
q 1 mol di K2Cr2O7
Esercizi sulla mole parte 2
14. Quale campione contiene il maggior numero di atomi?
q30 g di N2
q30 g di Fe
q30 g di H2
q30 g di He
15. Un becher contiene 75 mL di acqua. Quante molecole contiene?
16. Calcola la massa in un campione di 0,1 moli di Na Cl
Benvenuti ragazzi!
su questo sito troverete materiali e video per imparare
aprite la pagina della materia che vi interessa e... buon lavoro!
